Endogenní retroviry – genetické fosilie, nebo zombie?
| 17. 7. 2014Současný boom sekvenování celých genomů nejrůznějších organismů přináší záplavu dat, která posouvají naše znalosti o genetice, variabilitě a vzájemné příbuznosti druhů nebo celých taxonomických skupin. Nejnovějšími metodami dokážeme v krátké době sekvenovat genomy konkrétních jedinců včetně našich předchůdců z pozdního pleistocénu. Mimo jiné získáváme také informace o tom, že genomy obratlovců jsou plné retrovirových sekvencí, tedy úseků DNA, které odpovídají infekčním a zpravidla patogenním retrovirům. Přítomnost takových retrovirových sekvencí je dědičná a nezávisí na infekci prodělané zkoumaným jedincem, nazýváme je proto endogenní retroviry.
Již první celogenomové sekvence člověka zveřejněné v r. 2001 ukázaly, že zastoupení endogenních retrovirů je enormní: z celkové lidské DNA tvoří okolo 8 %, což je několikanásobně více než DNA kódující bílkoviny. Když připočítáme ostatní mnohonásobně opakované sekvence DNA, které se podobně jako retroviry pomnožují reverzní transkripcí z RNA do DNA, dostaneme se až k 45 % lidského genomu. Tak veliká frakce genomu tvořená v podstatě parazitickými a zčásti mobilními sekvencemi, vyvolává palčivé otázky. Jaký je původ endogenních retrovirů? Jak mohou genomy vlastně zvládat takovou zátěž, aniž by se rozpadly složité regulační sítě kontrolující buněčné funkce včetně dělení? Je-li v evoluci obratlovců udržováno takové množství genomových parazitů, mohou mít pro své hostitele nějaké prospěšné funkce?
Kde se vzaly?
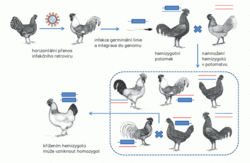 Původ endogenních retrovirů je nyní v hrubých rysech jasný: při retrovirové infekci mohou být infikovány také buňky germinální linie, tedy buňky, které dávají vznik příští generaci. U savců včetně člověka se nabízí např. spermatogonie, prekurzory spermií. Pokud se retrovirus dostane do buňky germinální linie a včlení se (integruje) do její DNA, bude mít jedinec vzniklý z této pohlavní buňky po jedné retrovirové kopii ve všech svých somatických buňkách, ale též ve všech buňkách pohlavních, kterými přenese retrovirovou kopii na všechny své potomky. Infekční retrovirus se stává endogenním a přenáší se nikoli horizontálně mezi jedinci v populaci, ale vertikálně, z rodiče na potomka. Pokud se při reprodukci sejdou dva příbuzní jedinci se stejnou retrovirovou integrací, může se v jejich potomstvu objevit retrovirová sekvence v homozygotním stavu, tj. ve dvou kopiích ve stejné pozici na obou chromozomech (obr. 1). Nakonec může dojít až k fixaci endogenního retroviru v populaci, to znamená, že nositelé konkrétní retrovirové kopie v populaci převládnou a v extrémním případě jedinci bez endogenního retroviru vymizí. Takový proces vyžaduje dostatek času a nenáhodné setkávání jedinců při reprodukci, ke kterému dochází v početně omezených populacích. V genomu člověka se všechny známé kopie nacházejí v homozygotním stavu. Jedním z možných vysvětlení je, že předkové moderního člověka se vyskytovali v malých populacích, kde se uplatňují jak náhodný genetický drift tak příbuzenská reprodukce. Endogenní retroviry nám uchovávají informaci o tom, jak vypadaly retroviry v dávné evoluční minulosti, jsou to vlastně virové fosilie.
Původ endogenních retrovirů je nyní v hrubých rysech jasný: při retrovirové infekci mohou být infikovány také buňky germinální linie, tedy buňky, které dávají vznik příští generaci. U savců včetně člověka se nabízí např. spermatogonie, prekurzory spermií. Pokud se retrovirus dostane do buňky germinální linie a včlení se (integruje) do její DNA, bude mít jedinec vzniklý z této pohlavní buňky po jedné retrovirové kopii ve všech svých somatických buňkách, ale též ve všech buňkách pohlavních, kterými přenese retrovirovou kopii na všechny své potomky. Infekční retrovirus se stává endogenním a přenáší se nikoli horizontálně mezi jedinci v populaci, ale vertikálně, z rodiče na potomka. Pokud se při reprodukci sejdou dva příbuzní jedinci se stejnou retrovirovou integrací, může se v jejich potomstvu objevit retrovirová sekvence v homozygotním stavu, tj. ve dvou kopiích ve stejné pozici na obou chromozomech (obr. 1). Nakonec může dojít až k fixaci endogenního retroviru v populaci, to znamená, že nositelé konkrétní retrovirové kopie v populaci převládnou a v extrémním případě jedinci bez endogenního retroviru vymizí. Takový proces vyžaduje dostatek času a nenáhodné setkávání jedinců při reprodukci, ke kterému dochází v početně omezených populacích. V genomu člověka se všechny známé kopie nacházejí v homozygotním stavu. Jedním z možných vysvětlení je, že předkové moderního člověka se vyskytovali v malých populacích, kde se uplatňují jak náhodný genetický drift tak příbuzenská reprodukce. Endogenní retroviry nám uchovávají informaci o tom, jak vypadaly retroviry v dávné evoluční minulosti, jsou to vlastně virové fosilie.
Nyní vidíte 16 % článku. Co dál:
O autorovi
Jiří Hejnar